-
La prevalenza delle ILD è stata stimata in 81/100.000 nei maschi e 67/100.000 nelle femmine.2
Tra le ILD, la classificazione più comune è la Fibrosi Polmonare Idiopatica (IPF). In Europa, la prevalenza dell'IPF variava da 1,25 a 23,4 casi per 100.000 abitanti.3
Inoltre, l'ILD si verifica nel 15% dei pazienti con malattie del tessuto connettivo (CTD), che è un gruppo di malattie autoimmuni di cui la più comune, l'artrite reumatoide (RA), colpisce tra lo 0,5% e il 2% della popolazione generale negli Stati Uniti.4
![]()
-
Percorso diagnostico
L'attuale percorso diagnostico prevede diversi passaggi:
- Esame fisico (ad es. test da sforzo cardiopolmonare, test della deambulazione di sei minuti);
- Test di funzionalità polmonare come la capacità vitale forzata (FVC) e lo scambio di gas (cioè la capacità di diffusione del polmone per il monossido di carbonio (DLCO));
- Test di imaging come i raggi X e l'HRCT (tomografia computerizzata);
- In caso di diagnosi ancora insufficiente vengono eseguiti lavaggi broncoalveolari (BALf) e/o biopsie
Le ILD più rilevanti possono essere associate a un fenotipo di fibrosi progressiva, il che porta a collegare questo gruppo di ILD con un termine noto come ILD fibrosanti progressive. Tra queste ILD a fibrosi progressiva ci sono: la fibrosi polmonare idiopatica (IPF), la polmonite da ipersensibilità (HP), le ILD autoimmuni (CTD-ILD), la sarcoidosi e le polmoniti interstiziali idiopatiche (IIP). Tutte queste ILD condividono una caratteristica di fibrosi progressiva indipendentemente dal fattore scatenante della fibrosi. 5
A causa di questo nuovo approccio, è diventato fondamentale identificare rapidamente i pazienti la cui malattia progredirà fino alla fibrosi polmonare estesa, e per questo motivo, l'uso di biomarcatori sierologici può essere un valore aggiunto nella valutazione dell'attività e nella previsione della malattia. 6
-
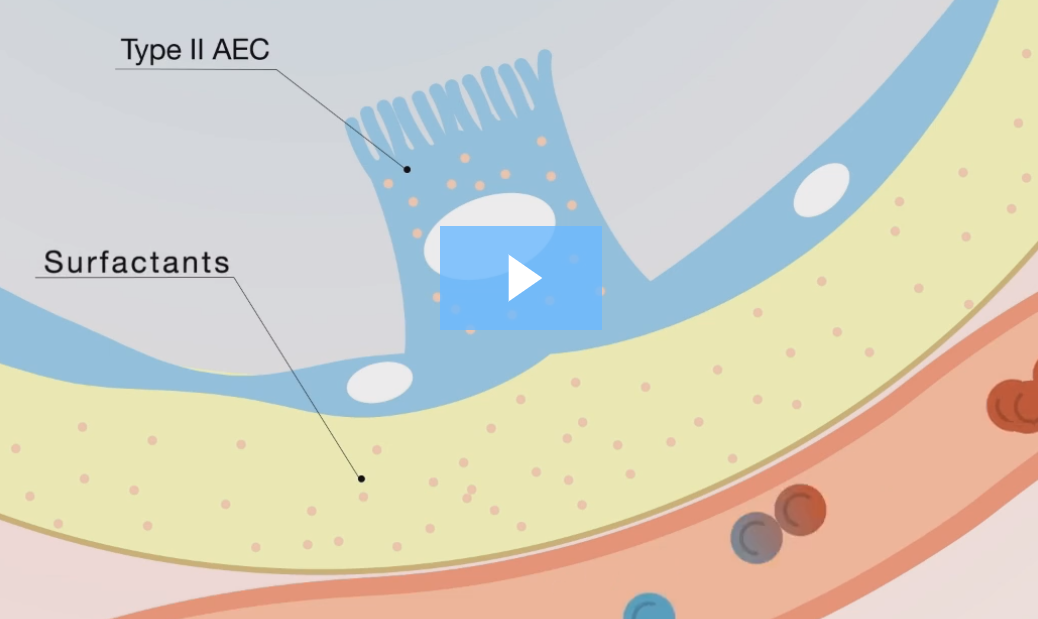
Krebs von den Lungen 6 (KL-6)
Krebs von den Lungen 6 (KL-6) è una glicoproteina mucinosa, ad alto peso molecolare, espressa sulla membrana superficiale delle cellule epiteliali alveolari (AEC-II) e delle cellule epiteliali bronchiolari. Esiste come componente solubile dopo scissione proteolitica nel liquido di rivestimento epiteliale polmonare.
La concentrazione sierica di KL-6 è elevata soprattutto per due meccanismi:
- Elevata produzione polmonare a causa di iperplasia diffusa delle cellule epiteliali alveolari (AEC, chiamate anche pneumociti).
- Aumento del rilascio nella circolazione sistemica a causa della perdita della membrana alveolo-capillare.
Guarda il nostro video didattico
-
Il significato clinico
Sono stati pubblicati più di 350 articoli che indagano il significato clinico di KL-6 in vari tipi di malattie polmonari interstiziali (ILD) e questi suggeriscono che i livelli sierici di KL-6 sono utili per: 6
- rilevare la presenza di malfunzionamenti/lesioni nelle AEC
- valutare l'attività della malattia
- prevedere gli esiti clinici in vari tipi di ILD
KL-6 può essere usato come marcatore prognostico poiché è stato dimostrato che gli individui con valori iniziali nel siero di KL-6 >1000 U/mL e aumenti seriali di KL-6 nel tempo sono associati a una sopravvivenza più breve, mentre gli individui con valori iniziali nel siero di KL-6 <1000 U/mL e nessun aumento seriale nel tempo sono stati associati a una sopravvivenza più lunga. 7
Inoltre, KL-6 può essere utile in altre condizioni cliniche, come la previsione della Esacerbazione Acuta (AE)8 o lo screening e il monitoraggio delle ILD associate alle Malattie del Tessuto Connettivo (CTD-ILD)9
-
References
- ATS / ERS. Am J Respir Crit Care Med 2002; 165: 277–304.
- Coultas DB, Zumwalt RE, Black WC, Sobonya RE. Am J Respir Crit Care Med 1994; 150:967-72.
- Luba Nalysnyk et al. Eur Respir Rev 2012; 21: 126, 355–361
- Koo SM and Uh ST. Korean J Intern Med 2017; 32:600-610
- Cottin V, Wollin L, Fischer A, et al. Eur Respir Rev 2019; 28: 180100
- Ishikawa N. et al. Respir Investig. 2012 Mar;50(1):3-13.
- Wakamatsu K et al. Respir Investig 2017, 55(1): 16-23
- Ohshimo S. et al. Respir Med. 2014 Jul; 108(7):1031-9
- Lee JS et al. Arthritis Res Ther. 2019 Feb 14; 21(1):58

Malattie polmonari interstiziali (ILD)
Milioni di persone soffrono di malattie polmonari che colpiscono diverse parti del sistema respiratorio, comprese le vie aeree, le sacche d'aria (gli alveoli), l'interstizio, i vasi sanguigni e la pleura.
Un gruppo grande ed eterogeneo di malattie chiamate malattie polmonari interstiziali (ILD) colpisce l'interstizio, un sottile strato di cellule tra gli alveoli, che contiene vasi sanguigni e cellule che supportano gli alveoli e che permettono un efficiente scambio di gas.
