-
La maladie en chiffres
Le processus de détérioration se produit lors d’un dépôt excessif de collagène et autres protéines du tissu conjonctif, provoquant une cicatrisation progressive du tissu pulmonaire par l'inflammation et la fibrose.Ce remodelage tissulaire désorganisé compromet le rôle vital des poumons dans sa fonction respiratoire, avec des conséquences dévastatrices en termes de capacité fonctionnelle, de qualité de vie et de mortalité accrue.1
La prévalence des PI a été estimée à 81/100 000 chez les hommes et 67/100 000 chez les femmes.2Parmi elles, la plus fréquente est la fibrose pulmonaire idiopathique (FPI). En Europe, la prévalence de la FPI varie entre 1,25 et 23,4 cas pour 100 000 habitants.3
En outre, les maladies interstitielles pulmonaires touchent 15 % des patients atteints de pathologies du tissu conjonctif (CTD). Il s’agit d’un groupe de maladies auto-immunes dont la plus courante, la polyarthrite rhumatoïde (PR), touche entre 0,5 et 2 % de la population aux États-Unis.4
![]()
-
Le diagnostic
La stratégie actuelle de diagnostic comporte plusieurs étapes :- Examen physique (c'est-à-dire test d'exercice cardio-pulmonaire, test de marche de six minutes) ;
- Evaluation de la fonction pulmonaire comme la capacité vitale forcée (CVF) et la mesure des échange gazeux (c'est-à-dire la capacité de diffusion du monoxyde de carbone (DLCO)) ;
- Examens d'imagerie médicale tels que radiographie et HRCT Scan;
- Si nécessaire pour confirmer le diagnostic, un lavage broncho-alvéolaire et/ou une biopsie peuvent être effectués
Les PI les plus significatives peuvent être associées à un phénotype de fibrose pulmonaire progressive, ce qui conduit à nommer ce groupe de PI pneumopathies interstitielles fibrosantes progressives (PI-FP). Parmi ces PI-FP on trouve la fibrose pulmonaire idiopathique (FPI), la pneumopathie d'hypersensibilité (PHS), les pneumopathies interstitielles avec manifestation auto-immunes ; la sarcoïdose et les pneumopathies interstitielles diffuses idiopathiques (PID). Toutes ces pneumopathies interstitielles ont en commun une fibrose progressive, indépendamment du facteur déclenchant la fibrose.5
Grâce à cette nouvelle approche, il est pertinent d'identifier rapidement les patients dont la maladie va évoluer vers une fibrose pulmonaire étendue. L'utilisation de biomarqueurs sériques peut représenter une valeur ajoutée dans le suivi de l’évolution et du pronostic de la maladie.6
-
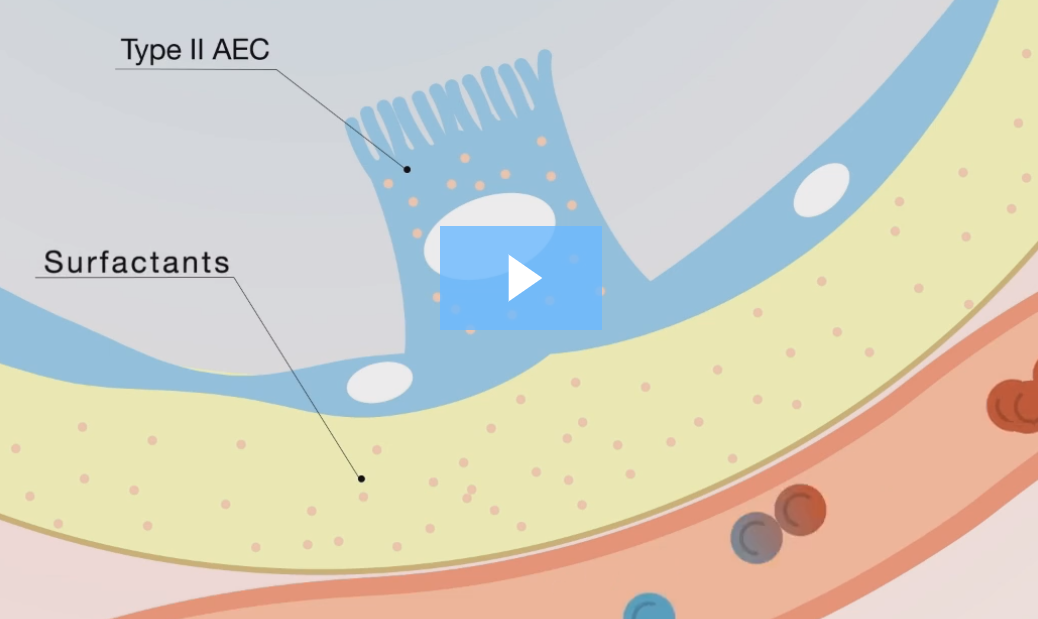
Krebs von den Lungen 6 (KL-6)
Krebs von den Lungen 6 (KL-6) est une glycoprotéine de haut poids moléculaire semblable à la mucine, exprimée sur les membranes des cellules épithéliales alvéolaires (CEA-II) et des cellules épithéliales bronchiolaires. Elle existe sous forme de composant soluble dans le liquide de la muqueuse épithéliale pulmonaire par clivage protéolytique.
La concentration sérique de KL-6 est élevée principalement en raison de deux mécanismes :
- Une production pulmonaire élevée due à une hyperplasie diffuse des cellules épithéliales alvéolaires (CEA, aussi appelées pneumocytes).
- Augmentation des déversements dans la circulation systémique en raison d'une fuite de la membrane alvéolo-capillaire.
Visionnez notre vidéo pédagogique
-
Pertinence clinique
Il existe plus de 350 publications sur la pertinence clinique de KL-6 dans différents types de pneumopathies interstitielles (PI) suggérant que les taux sériques de KL-6 sont utiles pour :6
- détecter la présence de lésions des cellules épithéliales alvéolaires
- évaluer l'activité de la maladie
- prévoir les résultats cliniques dans divers types de PI
Le KL-6 peut être utilisé comme marqueur pronostic puisqu'il a été démontré que les individus ayant à la fois un taux sérique initial de KL-6 >1000 U/mL et des augmentations successives du KL-6 présentent une survie plus courte, tandis que ceux ayant à la fois un taux sérique initial de KL-6 <1000 U/mL et pas d’augmentation successives du KL-6 présentent une survie globale plus longue.7
En outre, le KL-6 peut être utile dans d'autres situations cliniques, telles que la prédiction de l'exacerbation aiguë de la bronchopneumopathie chronique obstructive ou le dépistage et le suivi des pneumopathies interstitielles associées à une atteinte du tissu conjonctif.9
-
Bibliographie
- ATS / ERS. Am J Respir Crit Care Med 2002; 165: 277–304.
- Coultas DB, Zumwalt RE, Black WC, Sobonya RE. Am J Respir Crit Care Med 1994; 150:967-72.
- Luba Nalysnyk et al. Eur Respir Rev 2012; 21: 126, 355–361
- Koo SM and Uh ST. Korean J Intern Med 2017; 32:600-610
- Cottin V, Wollin L, Fischer A, et al. Eur Respir Rev 2019; 28: 180100
- Ishikawa N. et al. Respir Investig. 2012 Mar;50(1):3-13.
- Wakamatsu K et al. Respir Investig 2017, 55(1): 16-23
- Ohshimo S. et al. Respir Med. 2014 Jul; 108(7):1031-9
- Lee JS et al. Arthritis Res Ther. 2019 Feb 14; 21(1):58

Pneumopathies Interstitielles (PI)
Des millions de personnes souffrent de maladies pulmonaires affectant différentes parties du système respiratoire, comme les voies aériennes, les alvéoles, l'interstitium, les vaisseaux sanguins et la plèvre.
Un groupe important et hétérogène de maladies dénommées pneumopathies interstitielles (PI) ou pneumopathies parenchymateuses diffuses affectent l'interstitium. Il s’agit d’une fine couche cellulaire inter-alvéolaires contenant des vaisseaux sanguins et des cellules soutenant l’architecture des alvéoles, permettant ainsi un échange gazeux efficace.
