-
La prevalencia de las EPI se estima en 81/100.000 en hombres y 67/100.000 en mujeres.2
Entre las EPI, la clasificación más común es la Fibrosis Pulmonar Idiopática (FPI). En Europa, la prevalencia de FPI se estima entre 1,25 y 23,4 casos por cada 100.000 sujetos.3
Además, la EPI aparece en un 15% de los pacientes con enfermedades tejido-conectivas (ETC), que es un grupo de enfermedades autoinmunes, de las cuales la más frecuente, la artritis reumatoide (AR), afecta entre un 0.5% y un 2% de la población general en USA.4
![]()
-
Protocolo de diagnóstico
El proceso de diagnóstico actual incluye varios pasos:- Examen físico (p.e. prueba de esfuerzo cardiopulmonar, prueba de la marcha de los seis minutos);
- Pruebas de función pulmonar, como Capacidad Vital Forzada (CVF) e intercambio de gases (p.e. capacidad de difusión pulmonar para monóxido de carbono (DLCO);
- Pruebas de imagen como Rayos-X y HRCT (tomografía computerizada);
- En caso de que aun persista un diagnóstico insuficiente se realiza un Lavado Broncoalveolar (LBA) y/o una biopsia
Las EPIs más relevantes pueden ir asociadas con un fenotipo progresivo fibrosante, lo que lleva a vincular este grupo de enfermedades pulmonares intersticiales con un término conocido como enfermedad pulmonar intersticial progresiva. Entre estas EPIs con un fenotipo progresivo fibrosante encontramos: fibrosis pulmonar idiopática (FPI), neumonitis por hipersensibilidad (NH), EPIs asociadas a enfermedades autoinmunes (EPI-ETC), sarcoidosis y neumonías intersticiales idiopáticas (NIIs). Todos estas EPIs comparten una característica de fibrosis progresiva independientemente del desencadenante de la fibrosis.5
Debido a este nuevo enfoque, se ha vuelto crítico identificar rápidamente a los pacientes cuya enfermedad progresará hacia una fibrosis pulmonar extensa, y por esta razón, el uso de biomarcadores séricos puede aportar un valor adicional en la evaluación de la actividad de la enfermedad y en la predicción de la misma. 6
-
Krebs von den Lungen 6 (KL-6)
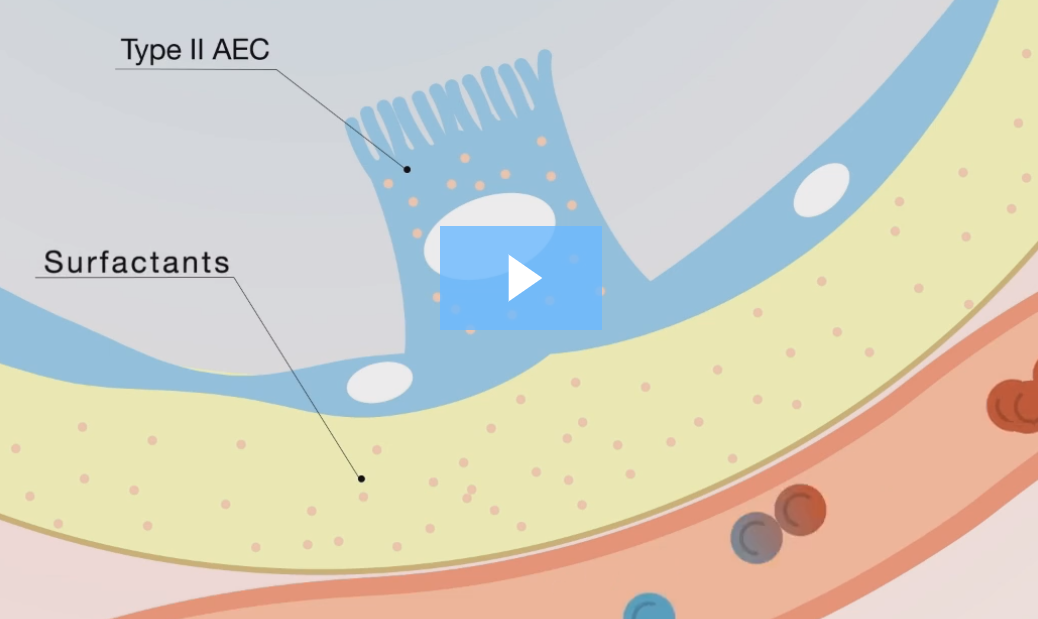
Krebs von den Lungen 6 (KL-6) es una glicoproteína mucinosa, de elevado peso molecular, expresada en la superficie de la membrana de las células epiteliales alveolares tipo II (AEC-II) y células epiteliales bronquiales. Aparece como componente solubilizado en el fluido pulmonar epitelial después de una ruptura proteolítica.
La concentración en suero de KL-6 se eleva principalmente debido a dos mecanismos:
- Elevada producción pulmonar debido a la hiperplasia difusa de las células epiteliales alveolares (AEC, también llamadas neumocitos)
- Aumento del derrame en la circulación sistémica debido a la fuga de la membrana alveolocapilar
Mire nuestro video educacional
-
Significado clínico
Se han publicado más de 350 artículos investigando sobre el significado clínico de KL-6 en varios tipos de enfermedades pulmonares intersticiales (EPIs) sugiriendo que los niveles séricos de KL-6 son útiles para: 6
- detectar la presencia de daño en las AEC
- evaluar la actividad de la enfermedad
- predecir el resultado clínico en varios tipos de EPIs
KL-6 puede ser usado como un marcador de pronóstico ya que se ha demostrado que los individuos con valores séricos iniciales de KL-6 > 1000 U/mL y con incrementos en serie de valores séricos de KL-6 se asocian con una supervivencia más corta, mientras que aquellos con suero inicial KL-6 < 1000 U/mL y sin ningún aumento en serie se asocian con una supervivencia más larga. 7
Además, KL-6 puede ser útil en otras condiciones clínicas, como la predicción de la Exacerbación Aguda (AE)8 o la detección y monitorización de la Enfermedad Tejido Conectiva (EPI-ETC).9
-
Referencias
- ATS / ERS. Am J Respir Crit Care Med 2002; 165: 277–304.
- Coultas DB, Zumwalt RE, Black WC, Sobonya RE. Am J Respir Crit Care Med 1994; 150:967-72.
- Luba Nalysnyk et al. Eur Respir Rev 2012; 21: 126, 355–361
- Koo SM and Uh ST. Korean J Intern Med 2017; 32:600-610
- Cottin V, Wollin L, Fischer A, et al. Eur Respir Rev 2019; 28: 180100
- Ishikawa N. et al. Respir Investig. 2012 Mar;50(1):3-13.
- Wakamatsu K et al. Respir Investig 2017, 55(1): 16-23
- Ohshimo S. et al. Respir Med. 2014 Jul; 108(7):1031-9
- Lee JS et al. Arthritis Res Ther. 2019 Feb 14; 21(1):58

Enfermedades Pulmonares Intersticiales (EPI)
Millones de personas padecen de enfermedades pulmonares que pueden afectar cualquier parte de su sistema respiratorio, incluyendo las vías respiratorias, los alveolos, el intersticio, los vasos sanguíneos y la pleura.
Un grupo grande de enfermedades conocidas como Enfermedades Pulmonares Intersticiales (EPI) afectan el intersticio, una fina capa de células entre los alveolos, que contiene vasos sanguíneos y células que ayudan a los alveolos, permitiendo un intercambio de gases eficiente.
