-
Durch die übermäßige Ablagerung von Kollagen und anderen Bindegewebsproteinen, die durch Entzündung und Fibrose eine fortschreitende Vernarbung des Lungengewebes verursachen, einsteht ein fehlerhafter Prozess. Dieser ungeordnete Gewebeumbau beeinträchtigt die lebenswichtige Rolle der Lunge bei der Atmung mit verheerenden Folgen für deren Funktionsfähigkeit, die Lebensqualität und eine erhöhte Mortalität.1
Die Prävalenz der ILDs wird für Männern auf 81/100.000 und bei Frauen auf 67/100.000 geschätzt.2
Innerhalb der ILDs ist die häufigste Klassifikation die Idiopathische Lungenfibrose (IPF). In Europa reicht die IPF-Prävalenz von 1,25 bis 23,4 Fällen pro 100.000 Einwohner.3
Darüber hinaus tritt die ILD bei 15% der Patienten mit Bindegewebserkrankungen (CTD) auf, einer Gruppe von Autoimmunerkrankungen, von denen die häufigste, die rheumatoide Arthritis (RA), zwischen 0,5% und 2% der Allgemeinbevölkerung in den USA betrifft.4
![]()
-
Diagnostische Pfade
Die derzeitige Diagnostik umfasst mehrere Schritte:- Körperliche Untersuchung (d.h. kardiopulmonaler Belastungstest, sechsminütiger Gehtest);
- Lungenfunktionstests wie die Forcierte Vitalkapazität (FVC) und Gasaustausch (d.h. Diffusionskapazität der Lunge für Kohlenmonoxid (DLCO));
- Bildgebende Tests wie Röntgenstrahlen und HRCT (Computertomographie-Scans);
- Bei noch unzureichender Diagnose werden Bronchoalveoläre Lavage (BALf) und/oder Biopsie durchgeführt
Der Großteil der wichtigsten ILDs können mit einem progressiv-fibrosierenden Phänotyp assoziiert sein. Dies ermöglicht diese Gruppe von ILDs mit einem Begriff zu umfassen: progressiv-fibrosierende ILDs. Zu diesen progressiv-fibrosierenden ILDs gehören: idiopathische Lungenfibrose (IPF), hypersensitive Pneumonitis (HP), Autoimmun-ILDs (CTD-ILD), Sarkoidose und idiopathische interstitielle Pneumonien (IIPs). Allen diesen ILDs ist unabhängig vom Auslöser der Fibrose das Merkmal des progressiv-fibrosierenden Geschehens gemeinsam.5
Aufgrund dieses neuen Ansatzes ist es von entscheidender Bedeutung geworden, Patienten, deren Krankheit zu einer ausgedehnten Lungenfibrose fortschreiten wird, rasch zu identifizieren. Aus diesem Grund kann die Verwendung von Serum-Biomarkern bei der Beurteilung der Krankheitsaktivität und der Vorhersage der Krankheit von zusätzlichem Wert sein.6
-
Krebs von den Lungen 6 (KL-6)
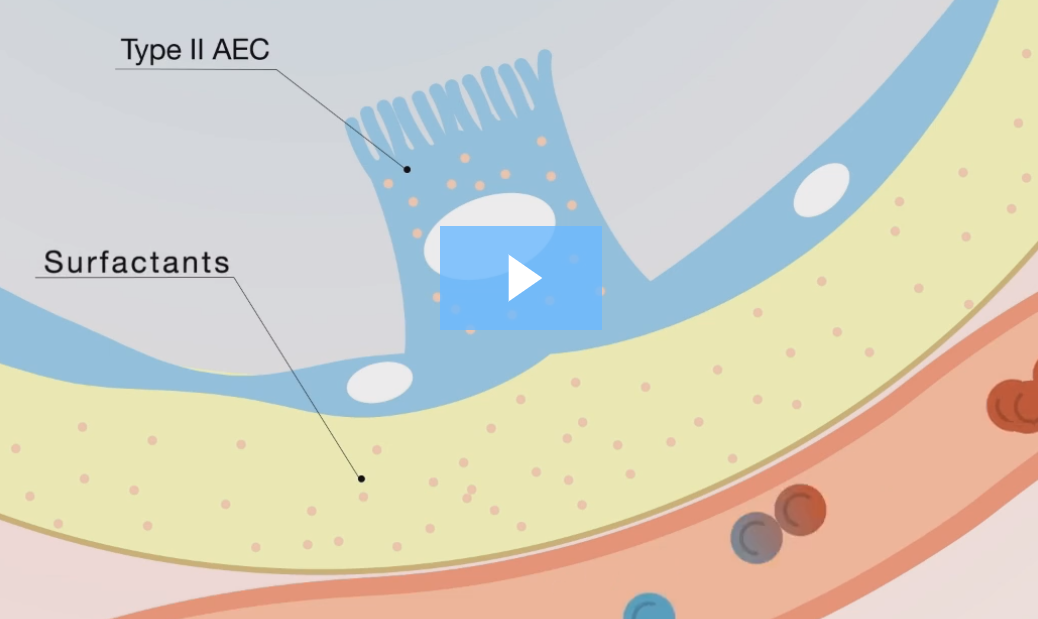
Krebs von den Lungen 6 (KL-6) ist ein muzinähnliches, hochmolekulares Glykoprotein, das auf der Oberflächenmembran von Alveolarepithelzellen (AEC-II) und Bronchiolarepithelzellen exprimiert wird. Es existiert als löslich Komponente in der Flüssigkeit des Lungenepithels durch proteolytische Spaltung.
Die KL-6-Serumkonzentration ist vor allem aufgrund zweier Mechanismen erhöht:
- Erhöhte pulmonale Produktion aufgrund diffuser Hyperplasie der alveolären Epithelzellen (AEC, auch Pneumozyten genannt)
- Erhöhter Übergang in die systemische Zirkulation durch die Alveolarkapillarmembran
Unser Video anschauen
-
Klinische Bedeutung
Mehr als 350 Arbeiten zur klinischen Bedeutung von KL-6 bei verschiedenen Arten von interstitiellen Lungenerkrankungen (ILDs) zeigen, dass die Serumspiegel von KL-6 nützlich sein kann für:6- die Feststellung des Vorhandenseins einer AEC-Verletzung
- die Bewertung der Krankheitsaktivität
- die Vorhersage klinischer Ergebnisse bei verschiedenen Arten von ILDs
KL-6 kann als prognostischer Marker verwendet werden. Es hat sich gezeigt, dass Individuen mit sowohl anfänglichen KL-6 im Serum von >1000 U/mL als auch mit einer seriellen Erhöhungen des KL-6 eine kürze Überlebenszeit aufweisen, im Vergleich zu Individuen mit sowohl geringerem anfänglichen KL-6 im Serum (<1000 U/mL) als auch ohne eine serielle Erhöhungen.7
Darüber hinaus kann KL-6 auch bei anderen Krankheitsbildern hilfreich sein, wie z.B. bei der Vorhersage einer akuten Exazerbation (AE)8 oder beim Screening und Monitoring von ILD im Zusammenhang mit einer Bindegewebserkrankung (CTD-ILD).9
-
Referenzen
- ATS / ERS. Am J Respir Crit Care Med 2002; 165: 277–304.
- Coultas DB, Zumwalt RE, Black WC, Sobonya RE. Am J Respir Crit Care Med 1994; 150:967-72.
- Luba Nalysnyk et al. Eur Respir Rev 2012; 21: 126, 355–361
- Koo SM and Uh ST. Korean J Intern Med 2017; 32:600-610
- Cottin V, Wollin L, Fischer A, et al. Eur Respir Rev 2019; 28: 180100
- Ishikawa N. et al. Respir Investig. 2012 Mar;50(1):3-13.
- Wakamatsu K et al. Respir Investig 2017, 55(1): 16-23
- Ohshimo S. et al. Respir Med. 2014 Jul; 108(7):1031-9
- Lee JS et al. Arthritis Res Ther. 2019 Feb 14; 21(1):58

Interstitielle Lungenerkrankungen (ILDs)
Millionen Menschen leiden an Lungenerkrankungen, welche verschiedene Bereiche des Atmungssystems betreffen, einschließlich der Atemwege, der Lungenbläschen (Alveolen), des Interstitiums, der Blutgefäße und des Rippenfells.
Eine große und heterogene Gruppe von Krankheiten, die als Interstitielle Lungenerkrankungen (ILDs) bezeichnet werden, betreffen das Interstitium, eine dünne Zellschicht zwischen den Alveolen. Diese enthält Blutgefäße und Zellen zur Unterstützung der Lungenbläschen für einen effizienten Gasaustausch.
